Đề thi học kì 2 môn Hóa lớp 12
Thời gian này các học sinh trên cả nước đang trong quá trình ôn tập để chuẩn bị bước vào kì thi học kì 2, giaitoan8.com chia sẻ các đề thi học kì 2 môn Hóa lớp 12 sẽ giúp các em ôn tập được thêm kiến thức của mình cũng như làm quen với cấu trúc đề thi có thể lặp lại trong bài thi mà thầy, cô giao cho mình trong kỳ thi hết học kì 2 sắp tới.
Ghi chú: Tải "Tài liệu, Lời giải" có phí, bạn liên hệ qua Zalo: 0363072023 hoặc Facebook TẠI ĐÂY.
Trong bộ đề thi học kì 2 môn Hóa lớp 12 dưới đây gồm 2 phần lý thuyết trắc nghiệm và phần tự luận, các em sẽ có 50 phút để hoàn thành bài thi của mình.

Mẫu đề thi học kì 2 môn Hóa lớp 12 sát chương trình và có đáp án
Đề thi học kì 2 môn Hóa lớp 12
A. PHẦN TRẮC NGHIỆM (6,0 Đ)
Cho: H=1; C=12; N=14; O=16; S= 32; Li=7; Na=23; K=39; Rb=85;Cs=133; Al=27; Cl=35,5; Fe=56; Zn=65; Ag=108; Cu=64; Be=9; Mg= 24; Ca=40; Sr= 88; Ba=137;
Câu 1: Sục khí CO2 đến dư vào dung dịch NaAlO2. Hiện tượng xảy ra là
A. có kết tủa nâu đỏ.
B. có kết tủa keo trắng, sau đó kết tủa lại tan.
C. dung dịch vẫn trong suốt.
D. có kết tủa keo trắng.
Câu 2: Vôi sống khi sản xuất phải được bảo quản trong bao kín. Nếu không để lâu ngày vôi sẽ “chết”. Phản ứng nào sau đây giải thích hiện tượng vôi “chết”
A. Ca(OH)2 + Na2CO3 -> CaCO3 + 2NaOH.
B. CaO + CO2 -> CaCO3.
C. CaCO3 + CO2 + H2O -> Ca(HCO3)2.
D. Ca(OH)2 + CO2 -> CaCO3 + H2O.
Câu 3: Cho một miếng Na vào dung dịch CuCl2 từ từ đến dư hiện tượng quan sát được
A. Có khí thoát ra và xuất hiện kết tủa xanh.
B. Có khí thoát ra.
C. Có khí thoát ra và xuất hiện kết tủa xanh và sau đó tan ra.
D. Có kết tủa màu xanh.
Câu 4: Dãy nào dưới đây gồm các chất vừa tác dụng với dung dịch axit vừa tác dụng với dung dịch kiềm?
A. Al2(SO4)3 và Al2O3
B. Al(OH)3 và Al2O3
C. Al(NO3)3 và Al(OH)3
D. AlCl3 và Al2(SO4)3
Câu 5: Mô tả không phù hợp với nhôm là:
A. Ở ô thứ 13, chu kì 3, nhóm IVA.
B. Mức oxi hóa đặc trưng là +3.
C. Tinh thể cấu tạo lập phương tâm diện.
D. Cấu hình electron [Ne]323p1.
Câu 6: Dãy kim loại bị thụ động trong axit HNO3 đặc, nguội là
A. Fe, Zn và Cr
B. Fe, Al và Zn
C. Fe, Al và Cr
D. Mg, Al và Cu
Câu 7: Cho sơ đồ chuyển hoá: 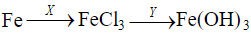
(mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là
A. HCl, NaOH.
B. HCl, Al(OH)3.
C. NaCl, Cu(OH)2.
D. Cl2, NaOH.
Câu 8: Trong các phản ứng hoá học cho dưới đây, phản ứng nào không đúng?
A. Fe + 2HCl -> FeCl2 + H2.
B. Fe + Cl2 -> FeCl2.
C. Fe + H2O -> FeO + H2 (đun trên 570oC).
D. Fe + CuSO4 -> FeSO4 + Cu.
Câu 9: Quặng sắt manhetit có thành phần chính là
A. Fe2O3.
B. FeS2.
C. Fe3O4.
D. FeCO3.
Câu 10: Khi nung nóng Fe với chất nào sau đây thì tạo ra hợp chất sắt (II)
A. O2
B. S
C. Cl2
D. Dung dịch HNO3
Câu 11: Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có
A. bọt khí và kết tủa trắng.
B. kết tủa trắng, sau đó kết tủa tan dần.
C. kết tủa trắng xuất hiện.
D. bọt khí bay ra.
Câu 12: Chỉ dùng dung dịch KOH để phân biệt được các chất riêng biệt trong nhóm nào sau đây?
A. Mg, Al2O3, Al.
B. Zn, Al2O3, Al.
C. Fe, Al2O3, Mg.
D. Mg, K, Na.
Câu 13: Fe có thể tan trong dung dịch chất nào sau đây?
A. FeCl2
B. AlCl3
C. MgCl2
D. FeCl3
Câu 14: Phương pháp quan trọng để điều chế kim loại kiềm là :
A. Điện phân dung dịch muối halogenua của kim loại kiềm giữa hai cực có màng ngăn xốp.
B. Điện phân dung dịch muối halogenua của kim loại kiềm giữa hai cực không có màng ngăn xốp.
C. Điện phân nóng chảy muối halogenua của kim loại kiềm .
D. Điện phân nóng chảy muối cacbonat của kim loại kiềm.
Câu 15: Khử hoàn toàn 17,6 gam hỗn hợp X gồm Fe, FeO, Fe2O3 cần 2,24 lít CO (ở đktc). Khối lượng sắt thu được là:
A. 8,0 gam.
B. 5,6 gam.
C. 6,72 gam.
D. 16,0 gam.
Câu 16: Cho từ từ dung dịch NaOH 1M vào dung dịch có chứa 26,7g AlCl3 cho đến khi thu được 11,7g kết tủa thì dừng lại. Thể tích dung dịch NaOH đã dùng là bao nhiêu lít?
A. 0,24 hoặc 0,45.
B. 0,45.
C. 0,65.
D. 0,45 hoặc 0,65.
Câu 17: Cho 38,795 gam hỗn hợp bột nhôm và nhôm clorua vào lượng vừa đủ dd NaOH thu được dd A ( kết tủa vừa tan hết ) và 6,72 lít H2 (đkc). Thêm 250 ml dd HCl vào dd A thu được 21,84 gam kết tủa. Nồng độ dd HCl là ?
A. 1,12 hay 3,84M
B. 2,24 hay 2,48M
C. 2,24 hay 3,84M
D. 1,12 hay 2,48M
Câu 18: Cho mg hỗn hợp bột Al và Fe tác dụng với dung dịch NaOH dư thấy thoát ra 6,72 lít khí (đktc). Nếu cho m (gam) hỗn hợp đó tác dụng với dd HCl thì thoát ra 8,96 lít khí (đktc). Khối lượng của Al và Fe là:
A. 5,4g và 5,6g.
B. 5,4g và 8,4g.
C. 10,8g, 5,6g.
D. 5,4g và 2,8g.
Câu 19: Cho 21,7g hỗn hợp A gồm 2 kim loại kiềm thổ tác dụng hết với dd HCl thì thu được 6,72 lít khí (đktc). Khối lượng muối khan thu được sau phản ứng là bao nhiêu.
A. 43,6g
B. 43g
C. 32g
D. 21,1g
Câu 20: Cho 0,04 mol bột Fe vào dd chứa 0,09 mol AgNO3. Khi phản ứng hoàn toàn thì chất rắn thu được có khối lượng bằng:
A. 9,72g
B. 4,32g
C. 8,64g
D. 1,12g
Câu 21: Nung m gam bột sắt trong oxi, thu được 3 gam hỗn hợp chất rắn X. Hòa tan hết hỗn hợp X trong dung dịch HNO3 (dư) thoát ra 0,56 lít NO (đktc) ( là sản phẩm khử duy nhất). Giá trị của m là:
A. 2,22 gam .
B. 2,52 gam.
C. 2,62 gam .
D. 2,32 gam
Câu 22: Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị 2, thu được 6,8g chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75ml dd NaOH 1M, khối lượng muối khan thu được sau phản ứng:
A. 6,5g.
B. 5,8g.
C. 4,2g.
D. 6,3g .
Câu 23: Cho 6,2 gam hỗn hợp 2 kim loại kiềm tác dụng hết với H2O thấy có 2,24 lít H2 (đktc) bay ra. Cô cạn dung dịch thì khối lượng chất rắn khan thu được là
A. 9,5 g
B. 9,4 g
C. 9,6 g
D. 9,7 g
Câu 24: Hòa tan 2,16 gam FeO trong lượng dư dung dịch HNO3 loãng thu được V lít (đktc) khi NO duy nhất. Gía trị của V là :
A. 0,336 lít
B. 2,240 lít
C. 0,224 lít
D. 0,448 lít
B. PHẦN TỰ LUẬN (4,0 Đ)
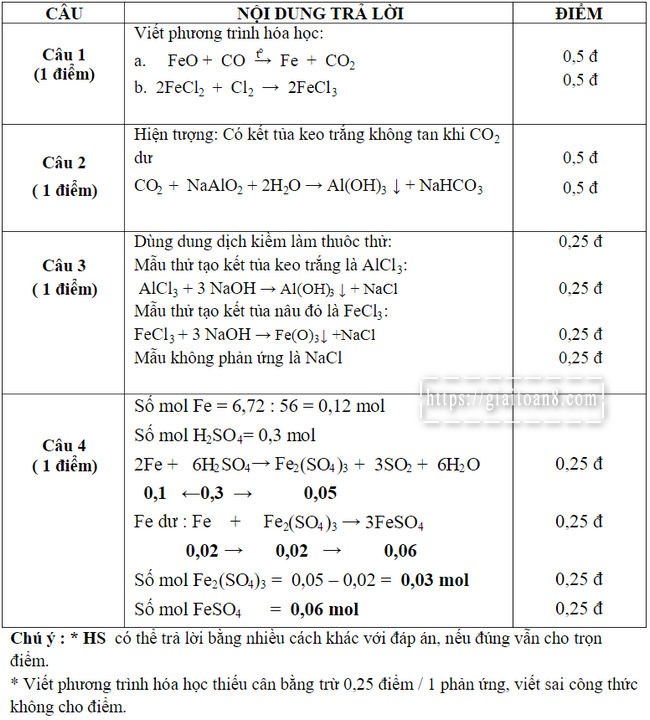
Câu 1: (1điểm).
Viết phương trình hóa học chứng minh:
a. FeO có tính oxi hóa.
b. FeCl2 có tính khử.
Câu 2: (1 diểm) Dẫn khí CO2 lấy dư qua dung dịch Aluminat natri ( NaAlO2). Hãy nêu hiện tượng xảy ra và viết phương trình hóa học để giải thích.
Câu 3: (1 diểm) Trình bày cách nhận biết 3 muối BaCl2 , AlCl3 và FeCl3 bằng 1 thuốc thử. Viết phương trình hóa học để giải thích.
Câu 4: (1 điểm) Cho 6,72 gam Fe vào dung dịch chứa 0,3 mol H2SO4 đặc nóng (giả thiết SO2 là sản phẩm khử duy nhất). Sau khi phản ứng xảy ra hoàn toàn, tính số mol muối thu được? Cho: Fe = 56; H = 1; S = 32; O = 16.
-------------HẾT-------------
Đáp án đề thi học kì 2 môn Hóa lớp 12
A. Phần lý thuyết
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | B | A | B | A | C | D | B | C | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | A | D | C | D | D | A | A | B | A |
| 21 | 22 | 23 | 24 | ||||||
| B | D | C | C |
II. Phần tự luận
Vượt qua đề thi học kì 2 môn Hóa lớp 12 trên đây, giaitoan8.com tin chắc rằng các em đã nắm chắc kiến thức để chuẩn bị tốt nhất cho các kỳ thi trước mắt, nếu thích theo khối B gồm Toán, Hóa, Sinh, các em xem thêm Đề thi học kì 2 môn Sinh lớp 12 ở đây.
Donate: Ủng hộ website Giaitoan8.com thông qua STK: 0363072023 (MoMo hoặc NH TPBank).
Cảm ơn các bạn rất nhiều!
- Đề thi học kì 1 lớp 11 môn Hóa học năm 2018-2019 tỉnh Quảng Nam
- Đề kiểm tra 15 phút môn Hóa học lớp 9 bài 4 Một số axit quan trọng
- Đề thi học kì 1 Hóa 12 Đoàn Thượng Hải Dương năm 2019 2020
- Đề thi học kì 2 môn Hóa lớp 10
- Đề kiểm tra 15 phút môn Hóa học lớp 9 bài Luyện tập Tính chất hóa học của oxit và axit
de thi hoc ki 2 mon hoa lop 12
đề thi học kì 2 lớp 12
Đề thi học kì 2 môn hóa lớp 12
Đề thi học kì 2 lớp 12 môn hóa

















